
Bảng tuần hoàn (tên không hề thiếu là Bảng tuần trả những nhân tố hóa học, còn được biết với thương hiệu Bảng tuần trả Mendeleev, là 1 trong cách thức liệt kê những nhân tố chất hóa học trở thành dạng bảng, dựa vào số hiệu vẹn toàn tử (số proton nhập phân tử nhân), thông số kỹ thuật electron và những đặc điểm chất hóa học tuần trả của bọn chúng. Các nhân tố được màn biểu diễn theo dõi trật tự động số hiệu vẹn toàn tử tăng dần dần, thông thường liệt kê cùng theo với ký hiệu chất hóa học trong những dù. Dạng xài chuẩn chỉnh của bảng bao gồm những nhân tố được bố trí trở thành 18 cột và 7 dòng sản phẩm, với nhì dòng sản phẩm kép ở riêng biệt ở bên dưới nằm trong.
Các mặt hàng nhập bảng gọi là những chu kỳ luân hồi, trong những khi những cột gọi là những group, một số trong những mang tên riêng biệt như halogen hoặc khí khan hiếm. Bởi vì như thế theo dõi khái niệm một bảng tuần trả thể hiện nay những Xu thế tuần trả, ngẫu nhiên bảng bên dưới dạng nào thì cũng hoàn toàn có thể dùng làm suy đi ra quan hệ Một trong những đặc điểm của nhân tố và tiên lượng đặc điểm của những nhân tố mới nhất, không được tò mò hoặc ko tổ hợp được. Do bại liệt, một bảng tuần hoàn-dù ở dạng xài chuẩn chỉnh hoặc những vươn lên là thể-cung cấp cho phạm vi hữu ích cho tới việc phân tách tính chất chất hóa học, và những bảng như thế được dùng rộng thoải mái nhập chất hóa học và những ngành khoa học tập không giống.
Bạn đang xem: Bảng tuần hoàn
Mặc dù là những người dân tiền phong trước bại liệt, Dmitri Ivanovich Mendeleev thông thường sẽ là người công tía bảng tuần trả thịnh hành thứ nhất nhập năm 1869. Ông đang được trở nên tân tiến bảng tuần trả của tôi nhằm minh họa những Xu thế tuần trả nhập tính chất những nhân tố đang được biết khi bại liệt. Mendeleev cũng tiên lượng một số trong những tính chất của những nhân tố không biết nhưng mà ông hy vọng tiếp tục lấp nhập những vị trí trống trải nhập bảng này. Hầu không còn những tiên lượng của ông trầm trồ đúng chuẩn khi những nhân tố bại liệt theo thứ tự được trừng trị hiện nay. Bảng tuần trả của Mendeleev kể từ này đã được không ngừng mở rộng và hiệu chỉnh với việc nhà tù giá chỉ hoặc tổ hợp thêm thắt những nhân tố mới nhất và sự trở nên tân tiến của những quy mô lý thuyết nhằm lý giải tính chất chất hóa học.
Tất cả những nhân tố đem số vẹn toàn tử từ là 1 (Hydro) cho tới 118 (oganesson) và được trừng trị hiện nay hoặc ghi nhận tổ hợp được, trong những khi những nhân tố 113, 115, 117 và 118 vẫn không được quá nhận rộng thoải mái. 98 nhân tố đầu tồn bên trên nhập ngẫu nhiên tuy vậy một số trong những chỉ nhìn thấy sau thời điểm đang được tổ hợp được nhập chống thực nghiệm và tồn bên trên với lượng đặc biệt nhỏ.[chú mến 1] Các nhân tố đem số hiệu vẹn toàn tử kể từ 99 cho tới 118 chỉ được tổ hợp đi ra, hoặc được tuyên tía là đang được tổ hợp được nhập chống thực nghiệm. Người tao hiện nay vẫn đang được theo dõi xua việc tạo nên những nhân tố đem những số hiệu vẹn toàn tử to hơn, tương đương giành giật cãi về thắc mắc rằng bảng tuần trả hoàn toàn có thể rất cần được hiệu chỉnh đi ra sao nhằm tương mến với những nhân tố mới nhất tiếp tục thêm nữa.
| Một phần của loạt bài xích về |
| Bảng tuần hoàn |
|---|
|
Các dạng bảng tuần hoàn
|
|
Lịch sử bảng tuần hoàn
|
|
Các giao hội vẹn toàn tố |
|
Theo cấu hình bảng tuần hoàn
|
|
Theo tính kim loại
|
|
Theo đặc điểm khác
|
|
Nguyên tố |
|
Danh sách nhân tố hóa học
|
|
Tính hóa học của vẹn toàn tố
|
|
Trang dữ liệu
|
|
|
Bố cục
- Chú thích: Đây là bố cục tổng quan bảng tuần trả 8 cột thịnh hành nhất, được gọi là dạng thông thường hoặc dạng xài chuẩn, hoặc đem khi gọi là dạng bảng dài nhằm đối với dạng bảng ngắn hoặc bảng loại Mendeleev Lưu trữ 2013-12-17 bên trên Wayback Machine, thông thường những group kể từ 3 cho tới 12 bằng phương pháp gộp nhập group chủ yếu. Bảng tuần trả rộng không giống ở vị trí chứa đựng luôn luôn cả chúng ta lanthan và chúng ta actini, thay cho tách bọn chúng ngoài phần đằm thắm chủ yếu của bảng. Bảng tuần trả cởi rộng thì thêm thắt những chu kì 8 và 9 chứa chấp những nhân tố xa xăm rộng lớn group actini.
Tất cả những phiên bạn dạng của bảng tuần trả chỉ bao hàm những nhân tố chất hóa học, ko bao hàm láo lếu ăn ý, ăn ý hóa học hoặc những phân tử hạ vẹn toàn tử.[chú mến 2] Mỗi nhân tố chất hóa học đem một số trong những hiệu vẹn toàn tử đặc thù đại diện thay mặt cho tới số proton đem nhập phân tử nhân của chính nó. Hầu không còn những nhân tố hoàn toàn có thể đem số neutron không giống nhau Một trong những vẹn toàn tử, những vươn lên là thể này gọi là những đồng vị của nhân tố bại liệt. Chẳng hạn, cacbon đem 3 đồng vị tồn bên trên nhập tự động nhiên: đa số cacbon ngẫu nhiên đem 6 proton và 6 neutron, tuy nhiên cỡ khoảng tầm 1% đem 8 neutron và một lượng đặc biệt nhỏ đem 7 neutron. Đồng vị ko tách tách nhưng mà gộp lại nhập một dù của bảng tuần trả như 1 nhân tố độc nhất với lượng khoảng theo dõi nồng độ. Những nhân tố không tồn tại đồng vị bền nào là đem lượng vẹn toàn tử vày của đồng vị bền nhất và được bịa nhập vệt ngoặc đơn.[1]

Trong bảng tuần trả xài chuẩn chỉnh, những nhân tố được liệt kê theo dõi trật tự số hiệu vẹn toàn tử tăng dần dần. Một mặt hàng mới nhất (tức một chu kỳ) chính thức khi một tờ electron mới nhất thêm nữa. Các cột (tức nhóm) được xác lập vày thông số kỹ thuật electron của vẹn toàn tử; những nhân tố đem nằm trong số electron nhập một phân lớp ví dụ rớt vào nằm trong cột (chẳng hạn oxi và seleni ở nằm trong cột chính vì bọn chúng đều phải sở hữu 4 electron ở phân lớp p ngoài cùng). Các nhân tố với đặc điểm chất hóa học tương tự động nhau thông thường ở trong nằm trong group, tuy vậy ở khối f và rất nhiều ở khối d, những nhân tố nằm trong chu kì cũng thông thường đem đặc điểm tương tự động nhau. Do bại liệt, người tao hoàn toàn có thể tiên lượng kha khá dễ dàng và đơn giản đặc điểm chất hóa học của một nhân tố nếu như biết đặc điểm của những nhân tố xung xung quanh nó.[2]
Tính cho tới mon 12 năm năm 2016, bảng tuần trả đem 118 nhân tố và được xác nhận, bao hàm những nhân tố từ là 1 (hiđrô) cho tới 118 (oganesson) nhập bại liệt những nhân tố 113, 115, 117 và 118 và được tổ hợp nhập chống thực nghiệm và những tuyên tía tổ hợp thành công xuất sắc bọn chúng và được IUPAC đầu tiên thừa nhận theo thứ tự là nihoni (Nh), moscovi (Mc), tennessine (Ts), và oganesson (Og).[3][4][5][6]
Tổng nằm trong 98 nhân tố xuất hiện nay nhập tự động nhiên; trăng tròn nhân tố sót lại, kể từ ensteini cho tới oganesson, chỉ xuất hiện nay nhập luật lệ tổ hợp tự tạo. Trong số 98 nhân tố bại liệt, 84 là nhân tố vẹn toàn thủy, tức thị xuất hiện nay trước lúc Trái Đất tạo hình. 14 nhân tố sót lại chỉ xuất hiện nay trong những chuỗi phân tan của những nhân tố vẹn toàn thủy.[7] Không đem nhân tố nào là nặng nề rộng lớn einsteini (số hiệu 99) từng để ý thấy với lượng mô hình lớn ở dạng tinh ranh khiết.[8]
Phương pháp chuẩn bị xếp
Nhóm
Trong bảng tuần trả, những nhân tố chất hóa học được bố trí theo dõi thân phụ phép tắc chủ yếu.
Các phép tắc bố trí này chung phân loại những nhân tố theo dõi cấu hình năng lượng điện tử và đặc điểm chất hóa học của bọn chúng. Các nhân tố nhập và một chu kỳ luân hồi thông thường đem những đặc điểm cơ vật lý không giống nhau, tuy nhiên đem sự thay cho thay đổi tuần trả của những đặc điểm chất hóa học khi dịch chuyển theo hướng ngang. Các nhân tố nhập và một group thông thường đem những đặc điểm chất hóa học tương đương, tự đem nằm trong số electron hóa trị.
Nguyên tắc 1
Các nhân tố được bố trí theo hướng tăng dần dần của số hiệu vẹn toàn tử (Z), tức là số proton nhập phân tử nhân.
Số hiệu vẹn toàn tử cũng chính là số trật tự của nhân tố bên trên bảng tuần trả.
Ví dụ, Hydro đem Z = 1, Heli đem Z = 2, v.v.
Nguyên tắc 2
Các nhân tố đem nằm trong số lớp electron nhập vẹn toàn tử được xếp trở thành một mặt hàng ngang, gọi là chu kỳ luân hồi. Có bảy chu kỳ luân hồi nhập bảng tuần trả, được viết số từ là 1 cho tới 7.
Số chu kỳ luân hồi thông qua số lớp electron lớn số 1 của nhân tố. Ví dụ, Carbon đem 2 lớp electron, nên nó nằm trong chu kỳ luân hồi 2. Uranium đem 7 lớp electron, nên nó nằm trong chu kỳ luân hồi 7.
Nguyên tắc 3
Các nhân tố đem nằm trong số electron hóa trị (số electron ở lớp bên ngoài cùng) nhập vẹn toàn tử được xếp trở thành một cột dọc, gọi là group. Có 18 group nhập bảng tuần trả, được viết số từ là 1 cho tới 18. Số group thông qua số electron hóa trị của nhân tố, trừ group 0 (nhóm 18) đem 8 electron hóa trị.
Ví dụ: Natri có một electron hóa trị, nên nó nằm trong group 1. Oxi đem 6 electron hóa trị, nên nó nằm trong group 16.
Nguồn: Bảng tuần trả hoá học
Một nhóm, còn gọi là 1 trong họ, là 1 trong cột đứng nhập bảng tuần trả. Các group thông thường thể nhiều Xu thế tuần trả cần thiết rộng lớn là những chu kỳ luân hồi và những khối. Các thuyết về cấu hình vẹn toàn tử nhập cơ học tập lượng tử văn minh lý giải rằng những nhân tố nhập và một group đem thông số kỹ thuật electron như nhau nhập lớp hóa trị của bọn chúng,[9] và vì thế những nhân tố nhập và một group đem đặc điểm chất hóa học tương đương nhau và thể hiện nay một Xu thế rõ nét trong những đặc điểm với số hiệu vẹn toàn tử tăng dần dần.[10] Tuy nhiên, nhập một vài ba phần của bảng tuần trả, như các khối d và f, tính tương đương theo hướng ngang hoàn toàn có thể cần thiết ko xoàng xĩnh, hoặc thậm chí còn cần thiết rộng lớn, tính tương đương theo dõi chiều dọc củ.[11][12][13]
Theo quy ước gọi là quốc tế, những group viết số từ là 1 cho tới 18 kể từ cột thứ nhất phía bên trái (kim loại kiềm) cho tới cột sau cùng phía bên phải (khí hiếm).[14] Trước phía trên, bọn chúng được tấn công trật tự theo dõi số La Mã. Tại Hoa Kỳ (và một số trong những nước khác) trước bại liệt, người tao phân những group nhập loại "A" nếu như group bại liệt chỉ chứa chấp lớp s hoặc p, hoặc "B" nếu như group bại liệt chứa chấp lớp d. Số La Mã vày mặt hàng đơn vị chức năng của trật tự cột kể từ ngược lịch sự nên (chẳng hạn, cột loại 4 là group IVB, và cột loại 14 là IVA). Các group loại 8, 9, 10 được xếp cộng đồng trở thành một group rộng lớn là VIIIB. Tiêu chuẩn chỉnh cũ của IUPAC từng xuất hiện ở châu Âu cũng tương tự động, trừ chữ "A" được sử dụng nếu như group ở trước 10 và "B" được sử dụng cho tới group 10 về bên sau; ngoại giả group VIIIB ở phía trên gọi là group VIII còn group VIIIA là group 0. Năm 1988, khối hệ thống gọi là IUPAC mới nhất đem hiệu lực thực thi, và những tên thường gọi group cũ theo dõi chữ số La Mã đang được bị loại bỏ vứt,[15] vẫn tồn bên trên ở một số trong những nước như nước ta. Tham khảo những cơ hội gọi thương hiệu group cũ và mới nhất trên bảng phía bên dưới.
Một số group này mang tên thường thì, ví dụ điển hình group 2 được gọi là group sắt kẽm kim loại kiềm thổ. Nhóm 3–10 ko mang tên cộng đồng của 3 group và sẽ là đơn giản và giản dị vày những group của bọn chúng hoặc vày tên thường gọi của tập thể nhóm thứ nhất nhập group của bọn chúng (như 'nhóm scandi' cho tới group 3), vì như thế bọn chúng thể hiện nay những Xu thế không nhiều tương đương rộng lớn theo dõi phương đứng.[14]
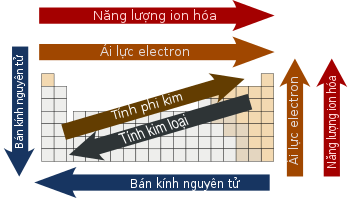
Các nhân tố nằm trong group đem khuynh phía thể hiện nay những dáng vẻ điệu tương tự động về nửa đường kính vẹn toàn tử, tích điện ion hóa, và chừng âm năng lượng điện. Từ bên trên xuống nhập và một group, nửa đường kính vẹn toàn tử tăng dần dần. Do có khá nhiều nấc tích điện được lấp ăm ắp rộng lớn, những electron hóa trị xuất hiện nay không ở gần phân tử nhân rộng lớn. Từ bên trên xuống, những nhân tố sau đem nấc tích điện ion hóa thấp rộng lớn, tức là dễ dàng tách electron thoát ra khỏi vẹn toàn tử vày links thủng thẳng chuồn. Tương tự động, nhập một group kể từ bên trên cuống tiếp tục hạn chế chừng âm năng lượng điện tự khoảng cách Một trong những electron hóa trị và phân tử nhân tăng dần dần.[16] Tuy nhiên những Xu thế này cũng có thể có nước ngoài lệ, ví dụ nhập group 11 thì chừng âm năng lượng điện tăng kể từ bên trên xuống.[17]
Chu kỳ
Một chu kỳ luân hồi là 1 trong mặt hàng ngang nhập bảng tuần trả. Mặc mặc dù group thường thì đem những Xu thế cần thiết rộng lớn, đem những vùng nhập bảng nhưng mà Xu thế theo hướng ngang cần thiết rộng lớn chiều dọc củ, như ở khối f, với những chúng ta Lanthan và chúng ta Actini tạo ra nhì chuỗi mặt hàng ngang cần thiết.[18]
Trong một chu kì kể từ ngược lịch sự nên, nửa đường kính vẹn toàn tử hạn chế dần dần tự từng nhân tố thêm nữa proton làm cho electron lớp bên ngoài bị kéo lại ngay sát phân tử nhân rộng lớn.[19] Bán kính vẹn toàn tử hạn chế thực hiện tích điện ion hóa và chừng âm năng lượng điện tăng dần[16] Ái lực electron cũng rất nhiều mang 1 Xu thế, với sắt kẽm kim loại (phía trái) thông thường đem ái lực electron thấp rộng lớn phi kim (phía mặt mũi phải) với nước ngoài lệ là những khí khan hiếm.[20]
Khối

Các vùng không giống nhau bên trên bảng tuần trả thỉnh thoảng sẽ là "khối" (tiếng Anh: "block") Theo phong cách nhưng mà những vỏ electron của những nhân tố được lấp ăm ắp. Mỗi lớp được gọi là theo dõi sự bố trí những electron sau cùng nhập vỏ.[21][chú mến 3] Khối s bao gồm nhì group thứ nhất (kim loại kiềm và kiềm thổ) tương đương hydro và heli. Khối p bao gồm 6 group cuối kể từ số 13 cho tới 18 theo dõi IUPAC (3A cho tới 8A theo dõi bảng hiện nay hành ở Việt Nam), nhập bại liệt đem toàn bộ những á kim và một số trong những sắt kẽm kim loại nằm trong phi kim. Khối d bao gồm những group loại 3 cho tới 12 theo dõi IUPAC (tức 3B cho tới 2B) và chứa chấp toàn bộ sắt kẽm kim loại gửi tiếp. Khối f, thông thường xếp riêng biệt bên dưới bạn dạng tuần trả, bao gồm những nhân tố sắt kẽm kim loại với những chúng ta lanthan và actini.[22]
Phân loại và những quy ước khác
Tùy theo dõi đặc điểm, những nhân tố nhập bảng tuần trả hoàn toàn có thể chia thành những loại đó là sắt kẽm kim loại, phi kim và á kim. Kim loại thông thường nằm bên cạnh ngược và phía bên dưới bảng tuần trả. Đặc trưng của bọn chúng là hóa học rắn, đem ánh kim, dẫn năng lượng điện và sức nóng đảm bảo chất lượng, hoàn toàn có thể tạo nên trở thành kim loại tổng hợp cùng nhau và ăn ý hóa học với phi kim. Phi kim nằm ở vị trí phía bên phải và phía bên trên. Chúng thông thường là những khí làm nên màu hoặc ko màu sắc, cơ hội năng lượng điện và sức nóng, tạo hình ăn ý hóa học hóa trị cùng nhau. Tại đằm thắm sắt kẽm kim loại và phi kim là á kim, đem đặc điểm trung gian lận hoặc phối kết hợp đằm thắm nhì loại bên trên.[23]
Kim loại và phi kim hoàn toàn có thể chia thành những đái thể loại hiện nay nhân tố hạn chế tính sắt kẽm kim loại và tăng tính phi kim kể từ ngược lịch sự nên. Kim loại chia thành sắt kẽm kim loại kiềm sinh hoạt mạnh, sắt kẽm kim loại kiềm thổ không nhiều sinh hoạt rộng lớn, rồi cho tới những chúng ta lanthan và actini, rồi cho tới những sắt kẽm kim loại gửi tiếp vẹn toàn hình, và kết giục ở những sắt kẽm kim loại yếu đuối rộng lớn về chất hóa học lẫn lộn cơ vật lý. Các phi kim đơn giản và giản dị chia thành phi kim nhiều vẹn toàn tử, ở ngay sát á kim nhất, thể hiện nay một ít đặc điểm sắt kẽm kim loại, những phi kim nhì vẹn toàn tử, thể hiện nay tính phi kim rõ nét, và sau cùng là những phi kim đơn vẹn toàn tử tức khí khan hiếm, gần như là trọn vẹn trơ và phi kim. Các loại đặc trưng như sắt kẽm kim loại độ chịu nhiệt và những sắt kẽm kim loại khan hiếm đều nằm trong nhập sắt kẽm kim loại gửi tiếp[24] và thỉnh thoảng cũng khá được thể hiện nay nhập bảng tuần trả.[25] Việc phân loại như vậy này tồn bên trên kể từ rất rất lâu, tối thiểu là từ thời điểm năm 1869 khi Hinrichs xác định rằng hoàn toàn có thể vạch những đàng đơn giản và giản dị bên trên bảng tuần trả nhằm chia nhỏ ra trở thành sắt kẽm kim loại, phi kim hoặc nhân tố khí.[26] Thực tế cơ hội phân loại này sẽ không tuyệt vời và hoàn hảo nhất vì như thế đem thật nhiều ông chồng lấn về đặc điểm ở ngay sát biên của những loại bên trên bảng tuần trả, và đem những nhân tố, như beryli, khó khăn nhưng mà phân vào trong 1 loại nào là.[27]
| Bố viên bảng tuần hoàn | |
|---|---|
 |
 |
| Họ lanthan và actini tách biệt (trái) hoặc nhập mặt hàng (phải) | |
Trong cơ hội màn biểu diễn bảng tuần trả, chúng ta lanthan và chúng ta actini thông thường thể hiện nay trở thành nhì mặt hàng bên dưới đằm thắm chủ yếu của bảng tuần trả, với những địa điểm đằm thắm bari và hafni, đằm thắm radi và rutherfordi được lưu lại vày ký hiệu hoặc vày một nhân tố đại diện thay mặt (lanthan và actini hoặc luteti và lawrenci)[28] Quy ước này đơn thuần là 1 trong yếu tố thẩm mỹ và làm đẹp và tính tiện lợi; một dạng bảng rộng lớn khan hiếm bắt gặp chèn những chúng ta nhân tố này nhập địa điểm đúng chuẩn của bọn chúng, tức là 1 trong phần của những mặt hàng (chu kỳ) 6 và 7. Một quy ước không giống cũng hoặc bắt gặp là 1 trong đàng phân tách đằm thắm sắt kẽm kim loại và phi kim, tuy rằng đàng này cũng có thể có những vươn lên là thể không giống nhau và ko trên bảng tuần trả đầu tiên của IUPAC.[29]
Xu phía tuần hoàn
Cấu hình electron

Cấu hình electron, tức cơ hội phân bổ electron xoay xuay xung xung quanh những vẹn toàn tử dung hòa, thể hiện nay một dáng vẻ điệu tuần trả. Electron cướp một chuỗi những lớp vỏ electron (đánh vệt vày những vần âm in hoa kể từ K,L,M,N,... ứng với con số tử chủ yếu n=1,2,3,4,...). Mỗi lớp lại có một hoặc nhiều phân lớp (gọi là s,p,d,f và g, ứng với con số tử phụ m=0,1,2,3,4). Khi số hiệu vẹn toàn tử tăng, số electron tiếp tục theo thứ tự lấp ăm ắp những lớp và phân lớp này theo dõi quy tắc Klechkowski hoặc quy tắc trật tự tích điện thể hiện nay ở giản vật dụng hình mặt mũi. Trong bảng tuần trả, mọi khi electron chính thức cướp một tờ mới nhất ứng với cùng một chu kỳ luân hồi mới nhất chính thức vày một sắt kẽm kim loại kiềm.[30][31]
Xem thêm: Facebook
Vì đặc điểm cả một nhân tố đa phần tùy theo thông số kỹ thuật electron của chính nó, cho nên vì thế những đặc điểm này cũng thể hiện nay dáng vẻ điệu tuần trả. Chính tuần trả này đang được dẫn cho tới sự tạo hình lăm le luật tuần trả (tính hóa học của những nhân tố tái diễn với những khoảng tầm đều nhau) và những bảng tuần trả thứ nhất, tuy vậy bộc lộ của chính nó chỉ cảm nhận được sự để ý khi quy mô Bohr về cấu hình vẹn toàn tử Thành lập và hoạt động.[30][31]
Bán kính vẹn toàn tử

Bán kính vẹn toàn tử thay cho thay đổi Theo phong cách hoàn toàn có thể Dự kiến và lý giải được nhập toàn bảng tuần trả. Ví dụ, nửa đường kính vẹn toàn tử thông thường hạn chế dọc từ từng chu kỳ luân hồi của bảng tuần trả, kể từ những sắt kẽm kim loại kiềm cho tới những khí hiếm; và tăng theo hướng kể từ bên trên xuống trong những group. Bán kính tăng mạnh đằm thắm khí khan hiếm ở cuối từng chu kỳ luân hồi và sắt kẽm kim loại kiềm ở đầu chu kỳ luân hồi tiếp sau. Các Xu thế này của nửa đường kính vẹn toàn tử (cũng như nhiều đặc điểm cơ vật lý và chất hóa học không giống của những vẹn toàn tố) hoàn toàn có thể lý giải vày lý thuyết về lớp vỏ electron của vẹn toàn tử; bọn chúng cung ứng dẫn chứng cần thiết cho việc trở nên tân tiến và xác nhận của cơ học tập lượng tử.[32]
Các electron nhập phân lớp 4f, được lấp ăm ắp từ từ kể từ xeri (Z = 58) cho tới ytterbi (Z = 70) trầm trồ ko hiệu suất cao trong các việc che chắn năng lượng điện phân tử nhân tăng thêm kể từ những phân lớp ra phía bên ngoài. Kết ngược là những nhân tố ngay lập tức sau group lanthan đem nửa đường kính vẹn toàn tử nhỏ hơn hẳn như Dự kiến và hầu hết vày trúng nửa đường kính vẹn toàn tử những nhân tố nằm ở phía bên trên bọn chúng.[33] Hiện tượng này được gọi là sự việc teo ở chúng ta lanthan, mổi nhảy từ trên đầu chúng ta này cho tới platin (Z = 78), kể từ tiếp sau đó bị lép vế vày một cảm giác kha khá tính gọi là "hiệu ứng cặp trơ" [chú mến 5][34] Một cảm giác đem xuất xứ và bộc lộ tương tự động, sự teo khối d, xẩy ra đằm thắm khối d và khối p và khó khăn nhận biết rộng lớn ví với việc teo ở chúng ta lanthan.[33]
Năng lượng ion hóa

Mức tích điện ion hóa loại nhất (IE1 hoặc I1) là tích điện quan trọng nhằm tách một electron thoát ra khỏi vẹn toàn tử, và những nấc tích điện thứ hai, loại 3,.. khái niệm tương tự động. Đối với cùng một vẹn toàn tử cho tới trước, những nấc tích điện ion hóa tiếp sau tăng theo dõi cường độ ion hóa. Các electron ở những orbital càng ngay sát thì Chịu đựng lực mút hút tĩnh năng lượng điện càng lớn; vì thế lượng tích điện quan trọng nhằm tách electron tăng phổ biến. Năng lượng ion hóa tăng về phía bên trên phía bên phải của bảng tuần trả.[34]
Các bước nhảy rộng lớn nhập tích điện ion hóa phân tử tiếp tục xuất hiện nay khi tách một electron ngoài thông số kỹ thuật khí khan hiếm (lớp vỏ bão hòa). Chẳng hạn, tích điện ion hóa loại nhất và loại nhì của magnesi theo thứ tự là 738 kJ/mol và 1450 kJ/mol, tuy nhiên tích điện ion hóa loại thân phụ, kể từ Mg2+ (có thông số kỹ thuật khí khan hiếm 1s22s22p2) xuống Mg3+(1s22s22p1) đạt cho tới 7730 kJ/mol.[34]
Độ âm điện

Độ âm năng lượng điện là khuynh phía một vẹn toàn tử mút hút những electron.[35] Độ âm năng lượng điện của vẹn toàn tử Chịu đựng tác động của tất cả số hiệu vẹn toàn tử và khoảng cách Một trong những electron hóa trị và những phân tử nhân. Độ âm năng lượng điện càng tốt thì tài năng mút hút electron càng mạnh. Khái niệm này được Linus Pauling khuyến cáo thứ nhất năm 1932 và thang Pauling vẫn chính là hạ tầng tham ô chiếu rộng thoải mái cho tới chừng âm năng lượng điện cho tới ngày này, tuy rằng cũng tồn bên trên những cách thức không giống.[36] Nhìn cộng đồng, chừng âm năng lượng điện tăng kể từ ngược qua loa nên nhập một chu kỳ luân hồi, và hạn chế kể từ bên trên xuống nhập một group. Do bại liệt fluor có tính âm năng lượng điện lớn số 1 trong những nhân tố,[chú mến 6]trong khi Caesi có tính âm năng lượng điện thấp nhất, ít nhất là theo dõi những mối cung cấp tài liệu chủ công đang được đem.[17]
Có những nước ngoài lệ về phép tắc cộng đồng này. Galli và germani có tính âm năng lượng điện cao hơn nữa nhôm và silic theo dõi trật tự tự sự teo khối d. Những nhân tố của chu kỳ luân hồi 4 nằm ở sau dòng sản phẩm thứ nhất của những sắt kẽm kim loại gửi tiếp đem nửa đường kính vẹn toàn tử nhỏ phi lý tự những electron 3d ko che chắn hiệu suất cao năng lượng điện phân tử nhân tăng thêm, và độ cao thấp vẹn toàn tử nhỏ rộng lớn ứng chừng âm năng lượng điện to hơn.[17] Độ âm năng lượng điện cao phi lý của chì, nhất là lúc đối chiếu với thalli và bismuth, nhượng bộ như là 1 trong hệ ngược của sự việc tinh lọc tài liệu công tía (cũng như sự thiếu thốn thốn dữ liệu)-các cách thức đo lường và tính toán không giống cách thức Pauling đều thể hiện nay Xu thế tuần trả thông thường của những nhân tố này.[37]
Ái lực electron

Ái lực electron của một vẹn toàn tử là lượng tích điện hóa giải đi ra khi electron thêm nữa vẹn toàn tử dung hòa sẽ tạo trở thành ion âm. Mặc mặc dù ái lực electron thay cho thay đổi với những khoảng tầm rất rộng, người tao vẫn để ý thấy đem những dáng vẻ điệu chắc chắn. Nhìn cộng đồng, phi kim có mức giá trị ái lực electron dương nhiều hơn thế sắt kẽm kim loại, với clo có mức giá trị ái lực electron cao hơn nữa cả. Ái lực electron của khí khan hiếm ko đo lường được một cơ hội thuyết phục, cho nên vì thế bọn chúng đem hoặc không tồn tại những độ quý hiếm âm nhỏ.[40]
Ái lực electron tăng theo dõi chu kỳ luân hồi. Vấn đề này là vì sự lấp ăm ắp lớp vỏ hóa trị của vẹn toàn tử; một vẹn toàn tử group 17 hóa giải nhiều tích điện rộng lớn vẹn toàn tử group 1 nhận một electron vì như thế nó đạt đi học vỏ hóa trị bão hóa và vì thế bền lâu hơn.[40] Với cơ hội lý giải tương tự động, tao hoàn toàn có thể nhìn đợi để ý thấy Xu thế hạn chế ái lực electron kể từ bên trên xuống nhập một group. Electron thêm nữa tiếp tục rớt vào orbital không ở gần phân tử nhân rộng lớn. Do vậy electron này tiếp tục không nhiều bị mút hút nhập phân tử nhân rộng lớn và hoàn toàn có thể hóa giải không nhiều tích điện rộng lớn khi được thêm nữa. Tuy nhiên, theo hướng kể từ bên trên xuống, khoảng tầm 1/3 những nhân tố là phi lý, với những nhân tố nặng nề rộng lớn đem ái lực electron cao hơn nữa đối với nhân tố nằm trong group nhưng mà nhẹ nhàng rộng lớn. Phần rộng lớn điều này là vì sự che chắn xoàng xĩnh vày những electron lớp d và f. Việc hạn chế thường xuyên ái lực electron chỉ trúng với những vẹn toàn tử group 1.[41]
Tính kim loại
Năng lượng ion hóa, chừng âm năng lượng điện và ái lực electron càng thấp thì tính sắt kẽm kim loại càng mạnh và ngược lại, tính phi kim tăng thì những độ quý hiếm bên trên càng rộng lớn.[42] Theo bại liệt, tính sắt kẽm kim loại đem khuynh phía hạn chế nhập chu kỳ luân hồi và, với một số trong những địa điểm ko thường xuyên đa phần tự tài năng chắn phân tử nhân xoàng xĩnh vày electron những phân lớp d và f nằm trong cảm giác kha khá tính,[43] đem khuynh phía tăng dần dần nhập một group. Vì vậy, đa số những nhân tố đem tính sắt kẽm kim loại mạnh mẽ nhất (như xezi và franci) nằm ở vị trí góc bên dưới phía bên trái của bảng tuần trả truyền thống lịch sử và đa số những nhân tố đem tính phi kim mạnh mẽ nhất (ôxi, fluor, clo) ở góc cạnh bên trên phía bên phải. Sự phối kết hợp những Xu thế theo hướng đứng và chiều ngang của tính sắt kẽm kim loại lý giải ranh giới cuống quýt khúc phân tách tách đằm thắm sắt kẽm kim loại và phi kim bên trên một số trong những phiên bạn dạng bảng tuần trả, và việc xếp group một số trong những nhân tố ở cạnh đàng ranh này trở thành á kim.[44][45]
Lịch sử
Những nỗ lực khối hệ thống hóa đầu tiên

Năm 1789, Antoine Lavoisier công tía list 33 nhân tố chất hóa học, xếp group trở thành những hóa học khí, sắt kẽm kim loại, phi kim và "đất".[46] Các ngôi nhà chất hóa học đang được dành riêng cả một thế kỉ tiếp sau đó nhằm mò mẫm tìm kiếm một sơ vật dụng phân loại đúng chuẩn rộng lớn. Năm 1829, Johann Wolfgang Döbereiner nhận biết nhiều nhân tố hoàn toàn có thể group trở thành những cỗ thân phụ dựa vào đặc điểm chất hóa học. Lithi, natri và kali ví dụ điển hình, hoàn toàn có thể xếp nhập group những sắt kẽm kim loại mượt, dễ dàng phản xạ. Döbereiner cũng nhận biết rằng khi bố trí theo dõi lượng, nhân tố loại nhì trong những cỗ thân phụ thông thường ngay sát vày khoảng nằm trong của nhì nhân tố kia;[47] trong tương lai được gọi là "định luật cỗ thân phụ vẹn toàn tố".[48] Nhà chất hóa học Đức Leopold Gmelin thực hiện phân tích khối hệ thống này, và cho tới năm 1843 ông đã nhận được diện được 10 cỗ thân phụ, thân phụ group cỗ 4 và 1 group cỗ 5. Năm 1857 Jean-Baptiste Dumas công tía công trình xây dựng tế bào miêu tả quan hệ Một trong những group sắt kẽm kim loại không giống nhau. Mặc mặc dù nhiều ngôi nhà khoa học tập hoàn toàn có thể phát hiện quan hệ Một trong những group nhân tố nhỏ, chúng ta ko thể dựng lên một sơ vật dụng triết lý toàn cỗ bọn chúng.[47]
Năm 1858, August Kekulé để ý thấy rằng cacbon thông thường đem 4 vẹn toàn tử không giống links với nó. Ví dụ như Metan mang 1 vẹn toàn tử cacbon và 4 vẹn toàn tử hiđrô. Quan niệm hóa trị tạo hình kể từ đây; những nhân tố không giống nhau links với những số vẹn toàn tử không giống nhau.[49]
Năm 1862, Alexandre-Emile Béguyer de Chancourtois, một ngôi nhà địa hóa học Pháp, công tía một dạng bảng tuần trả nguyên sơ, nhưng mà ông gọi là "đường xoắn teluride" hoặc "đinh vít teluride" (tiếng Pháp: vis tellurique). De Chancourtois là kẻ thứ nhất nhận biết tính tuần trả của những nhân tố. Khi tố xếp theo dõi một đàng xoắn bên trên một hình ống theo dõi lượng vẹn toàn tử tăng dần dần, ông cho là những ngyên tố với đặc điểm tương tự động nhau nhượng bộ như xuất hiện nay theo dõi những khoảng cách thường xuyên. Bảng nhưng mà de Chancourtois khuyến cáo bao hàm một số trong những ion và ăn ý hóa học cạnh bên những nhân tố. Bài ghi chép của ông cũng dùng những thuật ngữ địa hóa học rộng lớn là chất hóa học và ko dùng một giản vật dụng nào; thành phẩm là nó không sở hữu và nhận được để ý cho tới khi công trình xây dựng của Dmitri Mendeleev xuất hiện nay.[50]
Năm 1864, Julius Lothar Meyer, một ngôi nhà chất hóa học Đức, công tía một bảng bao hàm 44 nhân tố xếp theo dõi hóa trị. Bảng này chỉ ra rằng những nhân tố với đặc điểm tương tự động thông thường đem cộng đồng hóa trị.[51] Đồng thời, ngôi nhà chất hóa học William Odling cũng công tía một bảng bố trí 57 nhân tố dựa vào lượng vẹn toàn tử. Với một số trong những vị trí trống trải và tính ko thường xuyên, ông nhận biết rằng cái dường như như thể tính tuần trả về lượng vẹn toàn tử nhập số những nhân tố bại liệt và rằng điều này ứng với "các cơ hội ghép group được ghi nhận của bọn chúng." [52] Odling ám chỉ cho tới phát minh về một lăm le luật tuần trả tuy nhiên không tuân theo xua cho tới nằm trong.[53] Về sau (năm 1870) ông xoay lịch sự khuyến cáo một sự phân loại nhân tố dựa vào hóa trị.[54]

Nhà chất hóa học người Anh John Newlands công tía hàng loạt bài xích báo từ thời điểm năm 1863 cho tới năm 1866 ghi nhận rằng khi những nguyên tố được xếp theo dõi trật tự lượng vẹn toàn tử tăng dần dần, những đặc điểm cơ vật lý và chất hóa học tái mét tục theo dõi những khoảng tầm 8 đơn vị chức năng, ông gọi bọn chúng là "octave" (bộ tám) Theo phong cách gọi những quãng tám nhập music.[55][56] Vấn đề này cũng khá được gọi là Định luật về những cỗ tám, song bị những người dân nằm trong thời chế diễu, và Hội Hóa học tập Luân Đôn kể từ chối ấn hành công trình xây dựng này.[57] Tuy nhiên Newlands đang được thảo đi ra một bảng nhân tố và người sử dụng nó nhằm tiên lượng sự tồn bên trên của những nhân tố không đủ, ví dụ điển hình germani.[58] Hội Hóa học tập chỉ ghi nhận ý nghĩa sâu sắc những tò mò của ông 5 năm sau thời điểm chúng ta thừa nhận Mendeleev.[59]
Năm 1867, Gustavus Hinrichs, một ngôi nhà chất hóa học gốc Đan Mạch thao tác làm việc ở Hoa Kỳ, công tía một khối hệ thống tuần trả xoắn ốc dựa vào phổ và lượng vẹn toàn tử, và những tính tương đương chất hóa học. Công trình của ông bị coi là lập dị, phô mẽ, rắm rối và điều này hoàn toàn có thể đang được ngăn trở sự quá nhận của xã hội khoa học tập.[60][61]
Bảng tuần trả của Mendeleev


Hai ngôi nhà chất hóa học, Dmitri Mendeleev người Nga và Julius Lothar Meyer người Đức song lập cùng nhau đang được công tía bảng tuần trả theo thứ tự nhập năm 1869 và 1870.[62] Bảng của Mendeleev là phiên bạn dạng thứ nhất của ông công tía, bạn dạng của Meyer là phiên bạn dạng không ngừng mở rộng của một bảng không giống năm 1864.[63] Cả nhì đều thi công bảng bằng phương pháp liệt kê những nhân tố theo dõi mặt hàng hoặc cột theo dõi trật tự lượng vẹn toàn tử và chính thức từng mặt hàng hoặc cột mới nhất khi những tính chất của nhân tố chính thức tái diễn.[64]
Sự ghi công giành cho bảng của Mendeleev tới từ nhì ra quyết định cần thiết của ông. Thứ nhất là ông nhằm dành riêng vị trí trống trải nhưng mà nhượng bộ như ứng với những nhân tố còn không được tò mò.[65] Mendeleev ko nên là ngôi nhà khoa học tập thứ nhất thực hiện vậy, tuy nhiên ông là kẻ thứ nhất được thừa nhận là dùng những Xu thế nhập bảng tuần trả nhằm tiên lượng đặc điểm của những nhân tố bị thiếu thốn, như galli và germani.[66] Quyết lăm le loại nhì là thỉnh thoảng bỏ dở trật tự động cứng nhắc theo dõi lượng vẹn toàn tử và hoán gửi những nhân tố phụ cận, ví dụ như teluride và iod, nhằm phân loại bọn chúng trở thành những chúng ta chất hóa học đảm bảo chất lượng rộng lớn. Với sư trở nên tân tiến của những lý thuyết về cấu hình vẹn toàn tử, người tao nhận biết rõ nét là Mendeleev đang được vô tình liệt kê những nhân tố theo dõi trật tự động số hiệu vẹn toàn tử (hay năng lượng điện phân tử nhân) tăng dần dần.[67]
Tầm cần thiết của số hiệu vẹn toàn tử so với việc tổ chức triển khai bảng tuần trả ko được quá nhận cho đến khi sự tồn bên trên và đặc điểm của proton và neutron được phân tích cụ thể rộng lớn. Các bảng tuần trả của Mendeleev dùng lượng vẹn toàn tử thay cho số hiệu vẹn toàn tử nhằm tổ chức triển khai những nhân tố, vấn đề hoàn toàn có thể xác lập với chừng đúng chuẩn kha khá cao ở thời bấy giờ. Khối lượng vẹn toàn tử thỏa mãn nhu cầu đa số những tình huống, mang đến một sự tế bào miêu tả đem tài năng tiên lượng đặc điểm của những nhân tố không biết đúng chuẩn rộng lớn ngẫu nhiên cách thức nằm trong thời nào là không giống. Việc thay cho thế thông qua số hiệu vẹn toàn tử trong tương lai mang đến từng chuỗi xác lập, dựa vào số vẹn toàn cho tới nhân tố vẫn được dùng cho tới ngày này trong cả khi những nhân tố tổ hợp đang rất được sản xuất và phân tích.[68]
Những trở nên tân tiến về sau


Năm 1871, Mendeleev công tía một dạng bảng tuần trả, đem những group nhân tố tương tự động nhau xếp trở thành những cột kể từ I cho tới VIII (như hình trên). Ông cũng thể hiện những tiên lượng cụ thể về đặc điểm của những nhân tố nhưng mà trước bại liệt ông từng ghi nhận là bị khuyết tuy nhiên hẳn nên tồn bên trên.[69] Những khoảng tầm trống trải này theo thứ tự lấp ăm ắp khi những ngôi nhà khoa học tập tò mò thêm thắt những nhân tố tồn bên trên nhập ngẫu nhiên.[70] Người tao từng cho rằng nhân tố ngẫu nhiên sau cùng được tò mò là franci (mà Mendeleev gọi eka-caesium) nhập năm 1939.[71] Nhưng một nhân tố được tổ hợp đợt thứ nhất nhập năm 1940 là plutoni về sau (1971) lại nhìn thấy với cùng một lượng đặc biệt nhỏ xuất hiện nay nhập ngẫu nhiên,[72] và cho tới năm 2011 người tao hiểu được toàn bộ những nhân tố cho đến californi hoàn toàn có thể xuất hiện nay nhập ngẫu nhiên tối thiểu là bên dưới dạng vết (hàm lượng đặc biệt nhỏ) trong những mỏ quặng urani tự bắt lưu giữ neutron và phân tan beta.[7]
Dạng bảng tuần trả thịnh hành hiện nay nay[21], thông thường gọi là dạng xài chuẩn chỉnh hoặc dạng thường thì, là bạn dạng tự Horace Groves Deming hiệu chỉnh. Năm 1923, ngôi nhà chất hóa học Hoa Kỳ này công tía những bảng tuần trả dạng cụt (gọi là loại Mendeleev) và vừa phải (dạng 18 cột)[73][chú mến 7] Merck and Company sẵn sàng dạng bảng vừa phải 18 cột của Deming năm 1928 và sản xuất rộng thoải mái trong những ngôi trường học tập ở Hoa Kỳ. Tới trong năm 1930 bảng của Deming đang được xuất hiện nay trong những cuốn tuột tay và tự điển bách khoa chất hóa học. Sự thịnh hành của chính nó cũng một trong những phần nhờ được Sargent-Welch Scientific Company sản xuất trong vô số nhiều năm.[75][76][77]
Với sự trở nên tân tiến của những lý thuyết cơ học tập lượng tử về thông số kỹ thuật electron nhập vẹn toàn tử, người tao nhận biết rằng từng chu kỳ luân hồi (hàng) nhập bảng ứng với việc lấp ăm ắp một tờ vỏ lượng tử electron. Những vẹn toàn tử to hơn có khá nhiều phân lớp electron rộng lớn, cho nên vì thế những bảng về sau đem những chu kỳ luân hồi càng ngày càng dài ra hơn nữa.[78]

Năm 1945, Glenn Seaborg, một ngôi nhà khoa học tập Hoa Kỳ, khuyến cáo rằng những nhân tố chúng ta actini, cũng tương tự chúng ta lanthan lấp ăm ắp một phân lớp f. Trước bại liệt chúng ta actini được cho rằng tạo nên trở thành một mặt hàng khối d loại tư. Đồng nghiệp của Seaborg răn dạy ông tránh việc công tía một khuyến cáo táo tợn như thế vì như thế nó hoàn toàn có thể thực hiện hư hỏng toàn cỗ sự nghiệp của ông. Seaborg vẫn mặc kệ công tía và fake thuyết này về sau được chứng tỏ là trúng, góp thêm phần chung ông nhận giải Nobel Hóa học tập năm 1951.[79][80][chú mến 8]
Mặc mặc dù những lượng đặc biệt nhỏ một vài ba nhân tố siêu urani tồn bên trên nhập ngẫu nhiên,[7] nhân loại biết cho tới bọn chúng thứ nhất qua loa tổ hợp tự tạo. Việc sản xuất đi ra bọn chúng đang được không ngừng mở rộng bảng tuần trả đáng chú ý, với member thứ nhất là neptuni (1939).[82] Vì nhiều nhân tố siêu urani rất là ko bền và phân tan nhanh gọn lẹ, bọn chúng thử thách việc trừng trị hiện nay và mò mẫm hiểu đặc điểm. Đã có khá nhiều giành giật cãi tương quan cho tới việc những chống thực nghiệm không giống nhau yêu cầu ghi công sáng tạo và kéo Từ đó là quyền gọi là cho những nhân tố mới nhất. Các nhân tố mang tên riêng biệt đầu tiên được thừa nhận mới đây nhất là flerovi (nguyên tố 114) và livermori (nguyên tố 116), cả nhì được gọi là ngày 31 mon 5 thời điểm năm 2012.[83] Năm 2010, một group hợp tác phân tích đằm thắm Nga và Hoa Kỳ ở Dubna, Moskva, Nga, tuyên tía tổ hợp thành công xuất sắc 6 vẹn toàn tử của nhân tố loại 117 ununsepti, khiến cho nó phát triển thành nhân tố được tuyên tía trừng trị hiện nay mới đây nhất.[84]
Các loại sắp xếp khác

Có nhiều bảng tuần trả với dạng không giống dạng xài chuẩn chỉnh. Trong khoảng tầm 100 năm kể từ khi bảng của Mendeleev xuất hiện nay năm 1869 người tao dự tính có tầm khoảng 700 phiên bạn dạng bảng tuần trả không giống nhau ấn hành.[85] Cùng với thật nhiều vươn lên là thể hình chữ nhật, cũng có thể có những hình dạng không giống, như các dạng tròn trặn, lập phương, ống trụ, trước mặt (kiều ngôi nhà), chuỗi xoắn, lăng trụ 8 cạnh, kim tự động tháp, dạng phân tách hạn chế, dạng cầu, tam giác và, lemniscate,....[chú mến 9] Mục đích của những bảng này thông thường là nhằm mục đích tô đậm hoặc nêu nhảy những tính chất chất hóa học hoặc cơ vật lý của những nhân tố khó khăn nhận biết nhập bảng tuần trả thường thì.[85]
Trong số những vươn lên là thể, một phiên bạn dạng khá thịnh hành là bạn dạng của Theodor Benfey (1960)[86], nhập bại liệt những nhân tố được bố trí theo dõi một chuỗi xoắn ốc liên tiếp, với hiđrô ở trung tâm và những nhân tố sắt kẽm kim loại gửi tiếp, những chúng ta lanthan và actini cướp những buôn bán hòn đảo.[87]
Hầu không còn những bảng tuần trả ở dạng phẳng lặng tuy nhiên cũng có thể có những phiên bạn dạng thân phụ chiều tồn bên trên tối thiểu là từ thời điểm năm 1862 (trước cả bảng 2 chiều của Mendeleev). Các ví dụ mới đây rộng lớn bao hàm Phân loại Tuần trả của Courtines (1925),[88] Hệ thống Phiến của Wringley (1949),[89] Chuỗi xoắn tuần trả của Giguère (1965)[90][chú mến 10] và Cây Tuần trả của Dufour (1996).[92] Đi xa xăm hơn thế nữa, Stowe tế bào miêu tả Bảng tuần trả cho tới Nhà cơ vật lý (1989) của mình[93] là 4 chiều (ba chiều không khí và một chiều màu sắc sắc).[94]
Các dạng bảng không giống nhau được cho rằng phía trên một continuum hóa-lý.[95] Về đỉnh điểm phía chất hóa học nhập continuum này hoàn toàn có thể thấy bảng Bảng tuần trả chất hóa học của Nhà chất hóa học vô sinh 'vô vẹn toàn tắc'[96] của Rayner-Canham (2002),[97] nhấn mạnh vấn đề những Xu thế và sắc thái tuần trả, và những quan hệ nằm trong tính chất chất hóa học dị thông thường. Tại ngay sát đặc biệt cơ vật lý là Bảng tuần trả chất hóa học bước ngược của Janet (1928). Bảng này còn có một cấu hình thể hiện nay côn trùng contact thân mật rộng lớn với cường độ lấp ăm ắp lớp vỏ electron và vì thế gầm rộng lớn với cơ học tập lượng tử.[98] Tại khoảng tầm đằm thắm là dạng xài chuẩn chỉnh thịnh hành, sẽ là tế bào miêu tả những Xu thế tuần trả thực nghiệm trong những hiện trạng cơ vật lý, tính dẫn năng lượng điện và dẫn sức nóng, và những số lão hóa, với những nhân tố không giống dễ dàng và đơn giản suy đi ra kể từ những kinh nghiệm truyền thống lịch sử nhập chống thực nghiệm chất hóa học.[99]
Bảng tuần trả bước ngược Janet | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Uue | Ubn |
| khối f | khối d | khối p | khối s | |||||||||||||||||||||||||||||
| Dạng bảng tuần trả này phù phù hợp với trật tự động nhập bại liệt những lớp electron lấp ăm ắp, thể hiện nay theo dõi chuỗi tất nhiên ở lề nên bắt buộc (đọc kể từ bên trên xuống bên dưới, kể từ ngược lịch sự phải). Vị trí của hêli (một khí hiếm) phía trên beri (một sắt kẽm kim loại kiềm thổ) bị nhiều ngôi nhà chất hóa học chỉ trích uy lực. | ||||||||||||||||||||||||||||||||
Các yếu tố và giành giật cãi liên quan
Các nhân tố không biết tính chất hóa học
Mặc mặc dù toàn bộ những nhân tố cho đến ununocti và được tò mò, nhập số những nhân tố sau hassi (nguyên tố 108), chỉ mất copernici (nguyên tố loại 112) là đang được xác lập được đặc điểm chất hóa học. Các nhân tố không giống hoàn toàn có thể bộc lộ không giống với cơ hội nước ngoài suy kể từ những chu kỳ luân hồi thấp rộng lớn, tự những cảm giác kha khá tính; ví dụ điển hình, người tao tiên lượng flevori là thể hiện nay đặc điểm tương đương khí khan hiếm, tuy vậy nó hiện nay được bịa nhập group cacbon.[100] Tuy nhiên những thực nghiệm mới đây lại khuyến cáo rằng flevori lại bộc lộ chất hóa học tựa như chì tự địa điểm nhập bảng tuần trả của chính nó.[101]
Mở rộng lớn bảng tuần trả nhập tương lai
Người tao hiện nay ko rõ rệt liệu những nhân tố mới nhất đem kế tiếp theo dõi trật tự động bảng tuần trả lúc này, thực hiện trở thành chu kỳ luân hồi 8 hay là không, hoặc tiếp tục có nhu cầu các sự nâng cấp hoặc hiệu chỉnh thêm thắt. Glenn T. Seaborg nhận định rằng chu kỳ luân hồi 8 tiếp tục chuồn theo như đúng trật tự động, bao hàm một khối s nhì nhân tố cho những nhân tố 119 và 120, một khối g mới nhất cho tới 18 nhân tố tiếp sau, và 30 nhân tố tiếp kế tiếp những khối f, d và p.[102] Gần phía trên, những ngôi nhà cơ vật lý như Pekka Pyykkö thể hiện fake thuyết rằng những nhân tố này sẽ không còn theo dõi quy tắc Klechkowski về phương pháp lấp ăm ắp lớp vỏ electron và tự này sẽ tác động cho tới hình dạng bảng tuần trả lúc này.[103]
Quy tế bào tối hậu
Các ngôi nhà khoa học tập cũng không biết hoàn toàn có thể đem toàn bộ từng nào nhân tố. Từ năm 1911 Elliod Adams đang được khuyến cáo, dựa vào sự bố trí những nhân tố theo dõi những mặt hàng ngang của bàng tuần trả, rằng những nhân tố với lượng to hơn khoảng tầm 256 lượng hiđrô (tức vày khoảng tầm đằm thắm nhân tố 99 và 100 hiện nay nay) ko tồn bên trên, một tiên lượng sớm trầm trồ sai lầm không mong muốn.[104] Một dự tính mới đây rộng lớn là bảng tuần trả hoàn toàn có thể kết giục ngay lập tức sau miền hòn đảo ổn định lăm le,[105] đem tâm xung xung quanh nhân tố 126, tự sự không ngừng mở rộng bảng tuần trả những nhân tố (cũng như các nuclid rằng chung) bị số lượng giới hạn vày proton và neutron trong mỗi loại gọi là "đường nhỏ giọt" (tức những đàng số lượng giới hạn của tính ổn định lăm le phân tử nhập bảng nuclid).[106] Các tiên lượng không giống bảng tuần trả kết giục ở nhân tố 128 như vày John Emsley,[7] nhân tố 137 như vày Richard Feynman[107] và nhân tố 155 vày Albert Khazan.[108][chú mến 11]
Hạn chế của những quy mô cơ học tập lượng tử lúc này làm cho việc xác lập nhân tố sau cùng khả dĩ của bảng tuần trả trở thành trở ngại. Mô hình Bohr tiên lượng rằng với số hiệu vẹn toàn tử to hơn 137, một vẹn toàn tử tiếp tục cần thiết electron phân lớp 1s dịch chuyển thời gian nhanh rộng lớn véc tơ vận tốc tức thời độ sáng, một điều bất khả; tuy nhiên quy mô này ko đúng chuẩn vì như thế ko xét cho tới cảm giác kha khá tính.[110] Các phương trình kha khá tính của Paul Dirac cũng bắt gặp yếu tố với những nhân tố đem nhiều hơn thế 137 proton. Với những nhân tố như thế, hàm sóng của hiện trạng Dirac cơ bạn dạng đem tính giao động rộng lớn là links, và không tồn tại khoảng cách nào là Một trong những phổ tích điện dương và âm, như nhập nghịch ngợm lý Klein.[111] Các bửa chủ yếu đi vào tương quan cho tới cảm giác độ cao thấp hữu hạn của phân tử nhân cho là tích điện links loại nhất tiếp tục vượt lên trước số lượng giới hạn cho những nhân tố nhiều hơn thế 137 proton. Đối với những nhân tố nặng nề rộng lớn, nếu như orbital nhập nằm trong (1s) ko bão trả, ngôi trường năng lượng điện kể từ của phân tử nhân tiếp tục kéo một electron thoát ra khỏi chân ko, dẫn cho tới sự phản xạ positron tự động phát;[112] song điều này sẽ không xẩy ra nếu như 1s bão hòa, vì thế nhân tố 137 ko nhất thiết là vấn đề tận nằm trong của bảng tuần trả.[107]
Các địa điểm ko tương hợp
Bảng tuần trả đem một số trong những phần ko tương ăn ý gây ra những thảo luận cho tới ngày này. Một nhập số này là địa điểm của hiđrô và heli thông thường được đặt tại những địa điểm ko ứng với thông số kỹ thuật electron của bọn chúng. Hiđrô phía trên lithi nhập bảng xài chuẩn chỉnh, tuy nhiên đem khi phía trên fluor, hoặc thậm chí còn cacbon vì như thế đặc điểm rất nhiều tương tự động với những nhân tố này.[113] thường thì hiđrô được đặt tại một group riêng biệt, vì như thế bộc lộ của chính nó ko đầy đủ tương đương với bất kì nhân tố nào là không giống nhằm ở cộng đồng một group.[114] heli thông thường đặt tại bên trên neon, tuy nhiên cũng có những lúc phía trên beryli theo dõi thông số kỹ thuật electron(heli: 1s2; beryli: [He] 2s2).[21]
Một yếu tố không giống tương quan cho tới những group chứa chấp những sắt kẽm kim loại gửi tiếp. Định nghĩa của IUPAC về sắt kẽm kim loại gửi tiếp là những nhân tố đem vẹn toàn tử với phân lớp d ko triển khai xong, hoặc hoàn toàn có thể tạo nên những cation với phân lớp d ko triển khai xong.[115] Theo khái niệm này toàn bộ những nhân tố trong những group kể từ 3 cho tới 11 là sắt kẽm kim loại gửi tiếp. Tuy nhiên một số trong những ngôi nhà chất hóa học vẫn coi "nguyên tố khối d" và "kim loại gửi tiếp" là những thuật ngữ hoán thay đổi được lẫn nhau, và vì thế bao hàm cả group 12 (kẽm, cadmi, thủy ngân), tuy vậy group này là nước ngoài lệ với những electron phân lớp d thông thường ko nhập cuộc nhập links chất hóa học. Gần phía trên người tao trừng trị sinh ra rằng thủy ngân hoàn toàn có thể dùng electron phân lớp d nhằm tạo hình thủy ngân fluorrit (HgF4), động viên cho tới lập luận rằng thủy ngân (và vì thế group 12) nên được đầu tiên thừa nhận là sắt kẽm kim loại gửi tiếp.[116] Tuy nhiên, những ngôi nhà comment như Jensen nhận định rằng sự tạo hình một ăn ý hóa học HgF4 chỉ xẩy ra bên dưới những ĐK rất là ko bình thường; và vì thế thủy ngân ko thể sẽ là sắt kẽm kim loại gửi tiếp sau bất kể cơ hội trình diễn giải phù hợp về nghĩa thường thì của thuật ngữ này.[117]. Cũng chuồn Theo phong cách trình diễn giải về hóa tính, một số trong những ngôi nhà chất hóa học không giống ra đi rộng lớn cho tới vị trí loại trừ những nhân tố group 3 thoát ra khỏi group sắt kẽm kim loại gửi tiếp. Lập luận của mình là group 3 ko tạo hình bất kì ion nào là đem phân lớp d bị cướp lưu giữ một trong những phần và vì thế ko thể hiện nay bất kì đặc điểm nào là đặc thù cho tới sắt kẽm kim loại gửi tiếp.[118]
Ngoài đi ra, ở group 3 cũng có thể có một yếu tố không giống tương quan cho tới những chu kỳ luân hồi sau của tập thể nhóm này. Người tao ko thống nhất được nhì nhân tố sau scandi và ytri là gì, một số trong những cho rằng lanthan và actini[119], tuy nhiên số không giống cho rằng luteti và lawrenci.[120] Có một vài ba lập luận, dựa vào cả chất hóa học và cơ vật lý, cỗ vũ uy lực cơ hội bố trí sau tuy nhiên ko nên ai ai cũng cảm nhận thấy bọn chúng đầy đủ thuyết phục.[121] Bảng tuần trả đầu tiên của IUPAC lúc bấy giờ chọn lựa cách thể hiện nay toàn bộ chúng ta lanthan và actini bằng phương pháp lưu lại bọn chúng nhập một dù của tập thể nhóm 3.[122] Định nghĩa của IUPAC về thuật ngữ "lanthanoid" (hay "lanthanide", tức chúng ta lanthan) bao hàm 15 nhân tố bao gồm cả lanthan và luteti, và "transition element" (nguyên tố gửi tiếp) vận dụng cho tới lanthan và actini, tương đương luteti tuy nhiên không đem lawrenci, chính vì nó ko tương phù hợp với nguyên tắc Aufbau.[115] Thông thông thường electron loại 103 tiếp tục chuồn nhập phân lớp d, tuy nhiên những phân tích cơ học tập lượng tử đã cho thấy thông số kỹ thuật thực tiễn là [Rn]5f147s27p1[chú mến 12] tự cảm giác kha khá tính. IUPAC hiện nay ko khuyến nghị một dạng ví dụ nào là cho tới khối f nhập mặt hàng của bảng tuần trả, làm cho yếu tố còn nhằm ngỏ..[123][124]
Xem thêm: lich ngay tot, xem ngay tot, xem ngay tot xau, tu vi, phong thuy, cung hoang dao
Dạng tối ưu
Sự tồn bên trên nhiều hình thức bảng tuần trả không giống nhau thực hiện trào lên thắc mắc liệu mang 1 dạng tối ưu xác lập rõ nét của bảng tuần trả. Câu vấn đáp có lẽ rằng tùy theo liệu tính tuần trả chất hóa học xẩy ra với những nhân tố mang 1 chân lý ngầm ẩn, kết nối nhập bạn dạng thể thiên hà, Hoặc là tính tuần trả bại liệt đơn giản thành phầm của cơ hội suy diễn khinh suất của nhân loại, tùy nằm trong nhập yếu tố hoàn cảnh, niềm tin cậy và thiên loài kiến của người xem. Bất kì hạ tầng khách hàng quan tiền nào là về tính chất tuần trả chất hóa học cũng tiếp tục nên giải quyết và xử lý những thắc mắc về địa điểm của hiđrô và heli hoặc kết cấu của tập thể nhóm 3 như đang được nêu bên trên. Một chân lý như vậy, nếu như tồn bên trên, lúc bấy giờ vẫn không tìm kiếm thấy cho nên vì thế với việc vắng tanh mặt mũi của chính nó, những dạng bảng tuần trả không giống nhau hoàn toàn có thể dược coi như thể những vươn lên là thể bên trên chủ thể về tính chất tuần trả chất hóa học, từng vươn lên là thể tò mò và nhấn mạnh vấn đề những góc nhìn, đặc điểm và những quan hệ không giống nhau Một trong những nhân tố.[chú mến 13] Sự thịnh hành của dạng bảng vừa phải của Deming nhưng mà ngày này tao gọi là dạng "tiêu chuẩn" hoàn toàn có thể là thành phẩm của sự việc thăng bằng đảm bảo chất lượng đằm thắm độ cao thấp và cấu hình tiện nghi, và sự minh họa trật tự động vẹn toàn tử và những Xu thế tuần trả.[53][127]
Xem thêm
- Nhóm tuần hoàn
- Chu kỳ tuần hoàn
- Thiên hà vẹn toàn tố
- Nguyên tử
- Bảng tuần trả cởi rộng
Chú thích
- ^ Các nhân tố trừng trị hiện nay ban sơ nhờ tổ hợp tuy nhiên về sau nhìn thấy nhập ngẫu nhiên là techneti (Z=43), promethi (61), astatin (85), franci (87), neptuni (93), plutoni (94), americi (95), curi (96), berkeli (97) và californi (98).
- ^ Một số bảng bao hàm cả nhân tố 0 (tức hóa học đơn thuần bao hàm neutron, song điều này hiếm hoi, như ở thiên hà nhân tố của Philip Stewart.
- ^ Có sự ko nhất quán và ko liên tiếp nhập quy ước này. Theo bại liệt, heli bịa nhập khối p tuy nhiên thực đi ra là 1 trong nhân tố khối s, và phân lớp d nhập khối thực đi ra lấp ăm ắp khi cho tới group 11 thay cho group 12.
- ^ Các khí khan hiếm, astatin, franci, và toàn bộ những nhân tố nặng nề rộng lớn americi bị loại bỏ đi ra vì như thế không tồn tại tài liệu tương quan.
- ^ Tiếng Anh: inert pair effect, là khuynh phía electron ở orbital ngoài nằm trong ko ion hóa hoặc không trở nên người sử dụng cộng đồng.Sidgwick, Nevil Vincent (1927). The Electronic Theory of Valency. Oxford: Clarendon. tr. 178–81.
- ^ Trong khi fluor có tính âm năng lượng điện lớn số 1 theo dõi thang Pauling, neon mới nhất là nhân tố hàng đầu về chừng âm năng lượng điện theo dõi những thang không giống, ví dụ điển hình thang Allen.
- ^ Một chi phí đằm thắm của bảng 17 cột của Deming hoàn toàn có thể thấy nhập Bảng tuần trả 16 cột của Adams năm 1911. Adams tách những nhân tố khu đất khan hiếm và những 'nguyên tố phóng xạ', tức chúng ta actini, ngoài phần đằm thắm và thể hiện nay bọn chúng bên dưới dạng còn khuyết chỉ nhằm tiết kiệm ngân sách và chi phí không khí (các nhân tố khu đất khan hiếm nằm trong lòng Ba và eka-Yt; những nhân tố phóng xạ ở đằm thắm eka-Te và eka-I).[74]
- ^ Một mặt hàng đặc biệt lâu năm những nhân tố, bao hàm những nhân tố đang được biết và không biết với lượng vẹn toàn tử to hơn bismut và được rằng từ thời điểm năm 1892. Hầu không còn những ngôi nhà phân tích tin cậy rằng bọn chúng tương đương với những nhân tố gửi tiếp ở chuỗi loại thân phụ. Sự tồn bên trên của một chuỗi gửi tiếp nhập loại nhì, bên dưới dạng chúng ta actini, chỉ được cháp nhận khi dẫn chứng đã cho thấy bọn chúng đem cấu hình electron tương tương tự động với chúng ta lanthan.[81]
- ^ Xem minh họa về những loại vươn lên là thể ở The Internet database of periodic tables.
- ^ Minh họa về bảng tuần trả của Giguère đặc biệt thịnh hành bên trên Internet (chẳng hạn ở đây) đều sai, vì như thế nó ko bao hàm hiđrô và heli. Giguère xếp hiđrô bên trên lithi và heli bên trên beryli.[91]
- ^ Karol (2002, tr. 63) quả quyết rằng cảm giác mê hoặc tiếp tục trở thành đáng chú ý khi số hiệu vẹn toàn tử chính thức trở thành đặc biệt rộng lớn, vì thế vượt lên những hiện nay ứng thất lạc ổn định lăm le không giống của phân tử nhân siêu nặng nề, và những sao neutron hoàn toàn có thể được coi như thể đại diện thay mặt cho tới những nhân tố nặng nề nhất (với vẹn toàn tử số lên tới mức cỡ 1021) nhập toàn thiên hà.[109]
- ^ Cấu hình được kỳ vọng của lawrenci nế như đó tuân theo dõi nguyên tắc Aufbau được xem là [Rn]5f146d17s2, với phân lớp 6d ko triển khai xong ở trong hiện trạng dung hòa.
- ^ Scerri, một trong mỗi Chuyên Viên nhiều tác động nhất về lịch sử dân tộc bảng tuần trả (Sella 2013), cỗ vũ ý niệm về một dạng bảng tuần trả tối ưu tuy nhiên mới đây đang được thay cho thay đổi ý kiến và xoay lịch sự cỗ vũ độ quý hiếm của sự việc tồn trên rất nhiều bảng tuần trả không giống nhau.[125][126]
Trích dẫn
- ^ Greenwood, tr. 24–27
- ^ Gray, tr. 6
- ^ CNN, Ashley Strickland. “New elements on the periodic table are named”. CNN. Truy cập ngày 11 mon 6 năm 2016.
- ^ “Discovery and assignment of elements with atomic numbers 113, 115, 117 and 118”. International Union of Pure and Applied Chemistry. ngày 30 mon 12 năm năm ngoái.
- ^ “Hello, Nihonium. Scientists Name 4 New Elements On The Periodic Table”. NPR.org. Truy cập ngày 11 mon 6 năm 2016.
- ^ Koppenol, W. H. (2002). “Naming of New Elements (IUPAC Recommendations 2002)” (PDF). Pure and Applied Chemistry. 74 (5): 787–791. doi:10.1351/pac200274050787.
- ^ a b c d Emsley, John (2011). Nature's Building Blocks: An A-Z Guide đồ sộ the Elements . Thủ đô New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Haire, Richard G. (2006). “Fermium, Mendelevium, Nobelium and Lawrencium”. Trong Morss; Edelstein, Norman M.; Fuger, Jean (biên tập). The Chemistry of the Actinide and Transactinide Elements (ấn bạn dạng 3). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1.
- ^ Scerri 2007, tr. 24
- ^ Messler, R. W. (2010). The essence of materials for engineers. Sudbury, MA: Jones & Bartlett Publishers. tr. 32. ISBN 0763778338.
- ^ Bagnall, K. W. (1967). “Recent advances in actinide and lanthanide chemistry”. Trong Fields, PR; Moeller, T (biên tập). Advances in chemistry, Lanthanide/Actinide chemistry. Advances in Chemistry. 71. American Chemical Society. tr. 1–12. doi:10.1021/ba-1967-0071. ISBN 0-8412-0072-6.
- ^ Day, M. C.; Selbin, J. (1969). Theoretical inorganic chemistry (ấn bạn dạng 2). Thủ đô New York, MA: Reinhold Book Corporation. tr. 103. ISBN 0763778338.
- ^ Holman, J.; Hill, G. C. (2000). Chemistry in context (ấn bạn dạng 5). Walton-on-Thames: Nelson Thornes. tr. 40. ISBN 0174482760.
- ^ a b Leigh, G. J. (1990). Nomenclature of Inorganic Chemistry: Recommendations 1990. Blackwell Science. ISBN 0-632-02494-1.
- ^ Fluck, E. (1988). “New Notations in the Periodic Table” (PDF). Pure Appl. Chem. IUPAC. 60 (3): 431–436. doi:10.1351/pac198860030431. Truy cập ngày 24 mon 3 năm 2012.
- ^ a b Moore, tr. 111
- ^ a b c Greenwood, tr. 30
- ^ Stoker, Stephen H. (2007). General, organic, and biological chemistry. New York: Houghton Mifflin. tr. 68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ^ Mascetta, Joseph (2003). Chemistry The Easy Way (ấn bạn dạng 4). New York: Hauppauge. tr. 50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ^ Kotz, John; Treichel, Paul; Townsend, John (2009). Chemistry and Chemical Reactivity, Volume 2 (ấn bạn dạng 7). Belmont: Thomson Brooks/Cole. tr. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ^ a b c Gray, tr. 12
- ^ Jones, Chris (2002). d- and f-block chemistry. New York: J. Wiley & Sons. tr. 2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ^ Silberberg, M. S. (2006). Chemistry: The molecular nature of matter and change (ấn bạn dạng 4). New York: McGraw-Hill. tr. 536. ISBN 0-07-111658-3.
- ^ Manson, S. S.; Halford, G. R. (2006). Fatigue and durability of structural materials. Materials Park, Ohio: ASM International. tr. 376. ISBN 0-87170-825-6.
- ^ Bullinger, Hans-Jörg (2009). Technology guide: Principles, applications, trends. Berlin: Springer-Verlag. tr. 8. ISBN 978-3-540-88545-0.
- ^ Hinrichs, G. D. (1869). “On the classification and the atomic weights of the so-called chemical elements, with particular reference đồ sộ Stas's determinations”. Proceedings of the American Association for the Advancement of Science. 18 (5): 112–124.
- ^ Jones, B. W. (2010). Pluto: Sentinel of the outer solar system. Cambridge: Cambridge University Press. tr. 169–71. ISBN 978-0-521-19436-5.
- ^ Gray, tr. 11
- ^ Jespersen, N. D. (2010). Barron's AP chemistry . Hauppauge, NY: Barron's Educational Series. tr. 117. ISBN 0-7641-4050-7.
- ^ a b Myers, R. (2003). The basics of chemistry. Westport, CT: Greenwood Publishing Group. tr. 61–67. ISBN 0-313-31664-3.
- ^ a b Chang, Raymond (2002). Chemistry (ấn bạn dạng 7). New York: McGraw-Hill. tr. 289–310, 340–42. ISBN 0-07-112072-6.
- ^ Greenwood, tr. 27
- ^ a b Jolly, W. L. (1991). Modern Inorganic Chemistry (ấn bạn dạng 2). McGraw-Hill. tr. 22. ISBN 978-0-07-112651-9.
- ^ a b c Greenwood, tr. 28
- ^ International Union of Pure and Applied Chemistry. "Electronegativity". Toàn văn bạn dạng Giản Lược Thuật Ngữ Hoá Học.
- ^ Pauling, L. (1932). “The Nature of the Chemical Bond. IV. The Energy of Single Bonds and the Relative Electronegativity of Atoms”. Journal of the American Chemical Society. 54 (9): 3570–3582. doi:10.1021/ja01348a011.
- ^ Allred, A. L. (1960). “Electronegativity values from thermochemical data”. Journal of Inorganic and Nuclear Chemistry. Northwestern University. 17 (3–4): 215–221. doi:10.1016/0022-1902(61)80142-5. Truy cập ngày 11 mon 6 năm 2012.
- ^ Huheey, Keiter & Keiter, tr. 42
- ^ Siekierski, Slawomir; Burgess, John (2002). Concise chemistry of the elements. Chichester: Horwood Publishing. tr. 35‒36. ISBN 1-898563-71-3.
- ^ a b Chang, tr. 307–309
- ^ Huheey, Keiter & Keiter, tr. 42, 880–81
- ^ Yoder, C. H.; Suydam, F. H.; Snavely, F. A. (1975). Chemistry (ấn bạn dạng 2). Harcourt Brace Jovanovich. tr. 58. ISBN 0-15-506465-7.
- ^ Huheey, Keiter & Keiter, tr. 880–85
- ^ Sacks, O (2009). Uncle Tungsten: Memories of a chemical boyhood. New York: Alfred A. Knopf. tr. 191, 194. ISBN 0-375-70404-3.
- ^ Gray, tr. 9
- ^ Siegfried, Robert (2002). From elements đồ sộ atoms: a history of chemical composition. Philadelphia, Pennsylvania: Library of Congress Cataloging-in-Publication Data. tr. 92. ISBN 0-87169-924-9.
- ^ a b Ball, tr. 100
- ^ Horvitz, Leslie (2002). Eureka!: Scientific Breakthroughs That Changed The World. New York: John Wiley. tr. 43. ISBN 978-0-471-23341-1. OCLC 50766822.
- ^ van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. tr. 19. ISBN 0-444-40776-6.
- ^ Annales des Mines history page.
- ^ Venable, pp. 85–86; 97
- ^ Odling, W. (2002). “On the proportional numbers of the elements”. Quarterly Journal of Science. 1: 642–648 (643).
- ^ a b Scerri, Eric R. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5.
- ^ Kaji, M. (2004). “Discovery of the periodic law: Mendeleev and other researchers on element classification in the 1860s”. Trong Rouvray, D. H.; King, R. Bruce (biên tập). The periodic table: Into the 21st Century. Research Studies Press. tr. 91–122 (95). ISBN 0-86380-292-3.
- ^ Newlands, John A. R. (ngày trăng tròn mon 8 năm 1864). “On Relations Among the Equivalents”. Chemical News. 10: 94–95.
- ^ Newlands, John A. R. (ngày 18 mon 8 năm 1865). “On the Law of Octaves”. Chemical News. 12: 83.
- ^ Bryson, Bill (2004). A Short History of Nearly Everything. Black Swan. tr. 141–142. ISBN 978-0-552-15174-0.
- ^ Scerri 2007, tr. 306
- ^ Brock, W. H.; Knight, D. M. (1965). “The Atomic Debates: 'Memorable and Interesting Evenings in the Life of the Chemical Society'”. Isis. The University of Chicago Press. 56 (1): 5–25. doi:10.1086/349922.
- ^ Scerri 2007, pp. 87, 92
- ^ Kauffman, George B. (tháng 3 năm 1969). “American forerunners of the periodic law”. Journal of Chemical Education. 46 (3): 128–135 (132). Bibcode:1969JChEd..46..128K. doi:10.1021/ed046p128.
- ^ Mendelejew, Dimitri (1869). “Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente”. Zeitschrift für Chemie (bằng giờ đồng hồ Đức): 405–406.
- ^ Venable, pp. 96–97; 100–102
- ^ Ball, tr. 100–102
- ^ Pullman, Bernard (1998). The Atom in the History of Human Thought. Translated by Axel Reisinger. Oxford University Press. tr. 227. ISBN 0-19-515040-6.
- ^ Ball, tr. 105
- ^ Atkins, P.. W. (1995). The Periodic Kingdom. HarperCollins Publishers, Inc. tr. 87. ISBN 0-465-07265-8.
- ^ Samanta, C.; Chowdhury, P.. Roy; Basu, D.N. (2007). “Predictions of alpha decay half lives of heavy and superheavy elements”. Nucl. Phys. A. 789: 142–154. arXiv:nucl-th/0703086. Bibcode:2007NuPhA.789..142S. doi:10.1016/j.nuclphysa.2007.04.001.
- ^ Scerri 2007, tr. 112
- ^ Kaji, Masanori (2002). “D.I. Mendeleev's Concept of Chemical Elements and the Principle of Chemistry” (PDF). Bull. Hist. Chem. Tokyo Institute of Technology. 27 (1): 4–16. Truy cập ngày 11 mon 6 năm 2012.
- ^ Adloff, Jean-Pierre; Kaufman, George B. (ngày 25 mon 9 năm 2005). “Francium (Atomic Number 87), the Last Discovered Natural Element”. The Chemical Educator. Bản gốc tàng trữ ngày 25 mon 9 năm 2013. Truy cập ngày 26 mon 3 năm 2007.
- ^ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. (1971). “Detection of Plutonium-244 in Nature”. Nature. 234 (5325): 132–134. Bibcode:1971Natur.234..132H. doi:10.1038/234132a0.
- ^ Deming, Horace G (1923). General chemistry: An elementary survey. New York: J. Wiley & Sons. tr. 160, 165.
- ^ Elliod Q. A. (1911). "A modification of the periodic table". Journal of the American Chemical Society. 33(5): 684–688 (687).
- ^ Abraham, M; Coshow, D; Fix, W. Periodicity:A source book module, version 1.0 (PDF). New York: Chemsource, Inc. tr. 3. Bản gốc (PDF) tàng trữ ngày 14 mon 5 năm 2012. Truy cập ngày 14 mon 8 năm 2014.
- ^ Emsley, J (ngày 7 mon 3 năm 1985). “Mendeleyev's dream table”. New Scientist: 32–36(36).
- ^ Fluck, E (1988). “New notations in the period table”. Pure & Applied Chemistry. 60 (3): 431–436 (432). doi:10.1351/pac198860030431.
- ^ Ball, tr. 111
- ^ Scerri 2007, tr. 270‒71
- ^ Masterton, William L.; Hurley, Cecile N.; Neth, Edward J. Chemistry: Principles and reactions (ấn bạn dạng 7). Belmont, CA: Brooks/Cole Cengage Learning. tr. 173. ISBN 1-111-42710-0.
- ^ Van Spronsen, J. W. (1969). The periodic system of chemical elements. Amsterdam: Elsevier. p. 315–316, ISBN 0-444-40776-6.
- ^ Ball, tr. 123
- ^ Barber, Robert C.; Karol, Paul J; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich W. (2011). “Discovery of the elements with atomic numbers greater than thở or equal đồ sộ 113 (IUPAC Technical Report)”. Pure Appl. Chem. 83 (7): 1485. doi:10.1351/PAC-REP-10-05-01.Quản lý CS1: nhiều tên: list người sáng tác (liên kết)
- ^ (tiếng Nga) “Эксперимент по синтезу 117-го элемента получает продолжение” [Experiment on sythesis of the 117th element is đồ sộ be continued]. JINR. 2012. Bản gốc tàng trữ ngày 29 mon 10 năm 2016. Truy cập ngày 28 mon 10 năm 2016.
- ^ a b Scerri 2007, p. 20
- ^ Emsely, J; Sharp, R (ngày 21 mon 6 năm 2010). “The periodic table: Top of the charts”. The Independent.
- ^ Seaborg, Glenn (1964). “Plutonium: The Ornery Element”. Chemistry. 37 (6): 14.
- ^ Mark R. Leach. “1925 Courtines' Periodic Classification”. Truy cập ngày 16 mon 10 năm 2012.
- ^ Mark R. Leach. “1949 Wringley's Lamina System”. Truy cập ngày 16 mon 10 năm 2012.
- ^ Mazurs, E.G. (1974). Graphical Representations of the Periodic System During One Hundred Years. Alabama: University of Alabama Press. tr. 111. ISBN 978-0-8173-3200-6.
- ^ Giguère P..A. (1966). "The "new look" for the periodic system". Chemistry in Canada 18 (12): 36–39 (tr. 37).
- ^ Mark R. Leach. “1996 Dufour's Periodic Tree”. Truy cập ngày 16 mon 10 năm 2012.
- ^ Mark R. Leach. “1989 Physicist's Periodic Table by Timothy Stowe”. Truy cập ngày 16 mon 10 năm 2012.
- ^ Bradley, David (ngày trăng tròn mon 7 năm 2011). “At last, a definitive periodic table?”. ChemViews Magazine. doi:10.1002/chemv.201000107.
- ^ Scerri 2007, pp. 285‒86
- ^ Scerri 2007, tr. 285
- ^ Mark R. Leach. “2002 Inorganic Chemist's Periodic Table”. Truy cập ngày 16 mon 10 năm 2012.
- ^ Scerri, Eric (2008). “The role of triads in the evolution of the periodic table: Past and present”. Journal of Chemical Education. 85 (4): 585–89 (see p.589). Bibcode:2008JChEd..85..585S. doi:10.1021/ed085p585.
- ^ Bent, H. A.; Weinhold, F (2007). “Supporting information: News from the periodic table: An introduction đồ sộ "Periodicity symbols, tables, and models for higher-order valency and donor–acceptor kinships"”. Journal of Chemical Education. 84 (7): 3–4. doi:10.1021/ed084p1145.
- ^ Schändel, Matthias (2003). The Chemistry of Superheavy Elements. Dordrecht: Kluwer Academic Publishers. tr. 277. ISBN 1-4020-1250-0.
- ^ Scerri 2011, tr. 142–143
- ^ Frazier, K. (1978). “Superheavy Elements”. Science News. 113 (15): 236–238. doi:10.2307/3963006. JSTOR 3963006.
- ^ Pyykkö, Pekka (2011). “A suggested periodic table up đồ sộ Z ≤ 172, based on Dirac–Fock calculations on atoms and ions”. Physical Chemistry Chemical Physics. 13 (1): 161–168. Bibcode:2011PCCP...13..161P. doi:10.1039/c0cp01575j. PMID 20967377.
- ^ Elliod, Q. A. (1911). “A modification of the periodic table”. Journal of the American Chemical Society. 33 (5): 684–688 (688). doi:10.1021/ja02218a004.
- ^ Transuranium element bên trên Encyclopædia Britannica (tiếng Anh)
- ^ Cwiok, S.; Heenen, P..-H.; Nazarewicz, W. (2005). “Shape coexistence and triaxiality in the superheavy nuclei”. Nature. 433 (7027): 705–9. Bibcode:2005Natur.433..705C. doi:10.1038/nature03336. PMID 15716943.
- ^ a b Ball, Philip (tháng 11 năm 2010). “Would Element 137 Really Spell the End of the Periodic Table? Philip Ball Examines the Evidence”. Royal Society of Chemistry. Truy cập ngày 30 mon 9 năm 2012.
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide đồ sộ the Elements . Thủ đô New York, NY: Oxford University Press. tr. 593. ISBN 978-0-19-960563-7.
- ^ Karol P.. J. (2002). "The Mendeleev–Seaborg periodic table: Through Z = 1138 and beyond". Journal of Chemical Education 79 (1): 60–63.
- ^ Eisberg, R.; Resnick, R. (1985). Quantum Physics of Atoms, Molecules, Solids, Nuclei and Particles. Wiley.
- ^ Bjorken, J. D.; Drell, S. D. (1964). Relativistic Quantum Mechanics. McGraw-Hill.
- ^ Greiner, W.; Schramm, S. (2008). “American Journal of Physics”. 76: 509. , và những chú mến nhập bài xích.
- ^ Cronyn, Marshall W. (tháng 8 năm 2003). “The Proper Place for Hydrogen in the Periodic Table”. Journal of Chemical Education. 80 (8): 947–951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947.
- ^ Gray, tr. 14
- ^ a b International Union of Pure and Applied Chemistry. "transition element". Toàn văn bạn dạng Giản Lược Thuật Ngữ Hoá Học.
- ^ Xuefang Wang; Lester Andrews; Sebastian Riedel; Martin Kaupp (2007). “Mercury Is a Transition Metal: The First Experimental Evidence for HgF4”. Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi:10.1002/anie.200703710. PMID 17899620.
- ^ William B. Jensen (2008). “Is Mercury Now a Transition Element?”. J. Chem. Educ. 85 (9): 1182–1183. Bibcode:2008JChEd..85.1182J. doi:10.1021/ed085p1182.
- ^ Rayner-Canham, G; Overton, T (2006). Descriptive inorganic chemistry (ấn bạn dạng 4). New York: W H Freeman. tr. 484–485. ISBN 0-7167-8963-9.
- ^ Barbalace, Kenneth. “Periodic Table of Elements”. Environmental Chemistry.com. Truy cập ngày 14 tháng bốn năm 2007.
- ^ “WebElements Periodic Table of the Elements”. Webelements.com. Truy cập ngày 3 tháng bốn năm 2010.
- ^ Scerri, E (2012). “Mendeleev's Periodic Table Is Finally Completed and What To Do about Group 3?”. Chemistry International. 34 (4).
- ^ “Periodic Table of the Elements”. International Union of Pure and Applied Chemistry. Truy cập ngày 3 tháng bốn năm 2010.
- ^ Eliav, E.; Kaldor, U.; Ishikawa, Y. (1995). “Transition energies of ytterbium, lutetium, and lawrencium by the relativistic coupled-cluster method”. Phys. Rev. A. 52: 291–296. Bibcode:1995PhRvA..52..291E. doi:10.1103/PhysRevA.52.291.
- ^ Zou, Yu; Froese, Fischer C. (2002). “Resonance Transition Energies and Oscillator Strengths in Lutetium and Lawrencium”. Phys. Rev. Lett. 88 (18): 183001. Bibcode:2002PhRvL..88b3001M. doi:10.1103/PhysRevLett.88.023001. PMID 12005680.
- ^ Sella A. (2013). 'An elementary history lesson'. New Scientist. 2929, truy vấn ngày 13 mon 8 năm 2014
- ^ Scerri, E. (2013). 'Is there an optimal periodic table and other bigger questions in the philosophy of science.', truy vấn ngày 4 mon 9 năm trước đó.
- ^ Francl, Michelle (tháng 5 năm 2009). “Table manners” (PDF). Nature Chemistry. 1 (2): 97–98. Bibcode:2009NatCh...1...97F. doi:10.1038/nchem.183. PMID 21378810.
Thư mục tham ô khảo
- Ball, Philip (2002). The Ingredients: A Guided Tour of the Elements. Oxford: Oxford University Press. ISBN 0-19-284100-9.
- Chang, Raymond (2002). Chemistry (ấn bạn dạng 7). New York: McGraw-Hill Higher Education. ISBN 978-0-19-284100-1.
- Gray, Theodore (2009). The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 978-0-08-022057-4.
- Huheey, JE; Keiter, EA; Keiter, RL (1993). Principles of structure and reactivity (ấn bạn dạng 4). New York: Harper Collins College Publishers. ISBN 0-06-042995-X.
- Moore, John (2003). Chemistry For Dummies. New York: Wiley Publications. tr. 111. ISBN 978-0-7645-5430-8. OCLC 51168057.
- Scerri, Eric (2007). The periodic table: Its story and its significance. Oxford: Oxford University Press. ISBN 0-19-530573-6.
- Scerri, Eric R. (2011). The periodic table: A very short introduction. Oxford: Oxford University Press. ISBN 978-0-19-958249-5.
- Venable, F P.. (1896). The development of the periodic law. Easton PA: Chemical Publishing Company.
Liên kết ngoài
Tìm hiểu thêm thắt về | |
| Từ điển kể từ Wiktionary | |
| Tập tin cậy phương tiện đi lại kể từ Commons | |
| Tin tức kể từ Wikinews | |
| Danh ngôn kể từ Wikiquote | |
| Văn khiếu nại kể từ Wikisource | |
| Tủ sách giáo khoa kể từ Wikibooks | |
| Tài vẹn toàn học hành kể từ Wikiversity | |
- Bảng tuần trả những nhân tố chất hóa học bên trên Từ điển bách khoa Việt Nam
- Periodic table of the elements bên trên Encyclopædia Britannica (tiếng Anh)
- OxNotes. “Periodic Table Revision Notes - IGCSE Chemistry - OxNotes GCSE Revision”. Truy cập ngày trăng tròn mon 12 năm 2013.
- M. Dayah. “Dynamic Periodic Table”. Truy cập ngày 14 mon 5 năm 2012.
- Brady Haran. “The Periodic Table of Videos”. University of Nottingham. Truy cập ngày 14 mon 5 năm 2012.
- Mark R. Leach. “The INTERNET Database of Periodic Tables”. Truy cập ngày 14 mon 5 năm 2012.
- IUPAC Periodic Table of the Elements Lưu trữ 2015-08-22 bên trên Wayback Machine Bảng tuần trả đầu tiên của IUPAC, 1/5 năm 2013
- Periodic Table on the Web Lưu trữ 2008-09-20 bên trên Wayback Machine Bảng tuần trả trực tuyến
Bảng tuần hoàn | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |





.jpeg)






Bình luận